Page 57 - Hóa phân tích
P. 57
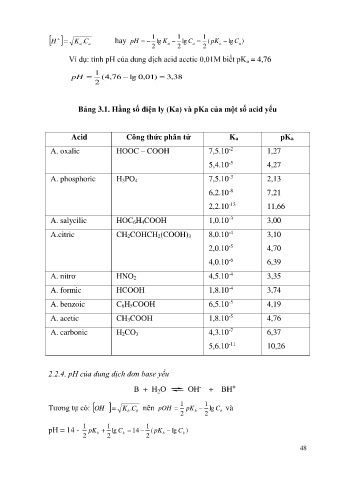
K C . hay pH 1 lg K 1 lg C 1 ( pK lg C a )
H
a
a
a
a
a
2 2 2
Ví dụ: tính pH của dung dịch acid acetic 0,01M biết pK a = 4,76
pH 1 ( 4 , 76 lg 0 , 01 ) , 3 38
2
Bảng 3.1. Hằng số điện ly (Ka) và pKa của một số acid yếu
Acid Công thức phân tử Ka pKa
-2
A. oxalic HOOC – COOH 7,5.10 1,27
5,4.10 -5 4,27
-3
A. phosphoric H 3PO 4 7,5.10 2,13
-8
6,2.10 7,21
-13
2,2.10 11,66
-3
A. salycilic HOC 6H 4COOH 1,0.10 3,00
A.citric CH 2COHCH 2(COOH) 3 8,0.10 -4 3,10
2,0.10 -5 4,70
4,0.10 -6 6,39
A. nitrơ HNO 2 4,5.10 -4 3,35
A. formic HCOOH 1,8.10 -4 3,74
A. benzoic C 6H 5COOH 6,5.10 -5 4,19
A. acetic CH 3COOH 1,8.10 -5 4,76
A. carbonic H 2CO 3 4,3.10 -7 6,37
5,6.10 -11 10,26
2.2.4. pH của dung dịch đơn base yếu
-
B + H O OH + BH +
2
1 1
Tương tự có: OH K C . nên pOH pK lg C và
b
b
b
b
2 2
1 1 1
pH = 14 - pK lg C 14 ( pK lg C )
2 b 2 b 2 b b
48