Page 58 - Hóa phân tích
P. 58
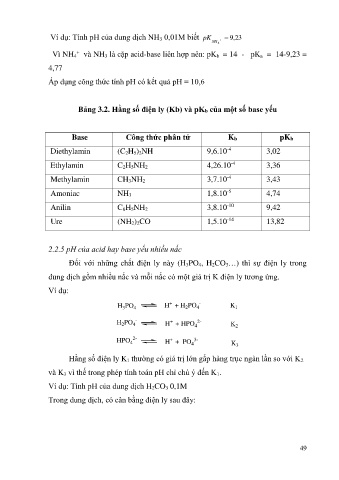
Ví dụ: Tính pH của dung dịch NH 3 0,01M biết pK , 9 23
NH 4
+
Vì NH 4 và NH 3 là cặp acid-base liên hợp nên: pK b = 14 - pK a = 14-9,23 =
4,77
Áp dụng công thức tính pH có kết quả pH = 10,6
Bảng 3.2. Hằng số điện ly (Kb) và pKb của một số base yếu
Base Công thức phân tử Kb pKb
Diethylamin (C 2H 5) 2NH 9,6.10 -4 3,02
Ethylamin C 2H 5NH 2 4,26.10 -4 3,36
Methylamin CH 3NH 2 3,7.10 -4 3,43
Amoniac NH 3 1,8.10 -5 4,74
Anilin C 6H 5NH 2 3,8.10 -10 9,42
-14
Ure (NH 2) 2CO 1,5.10 13,82
2.2.5 pH của acid hay base yếu nhiều nấc
Đối với những chất điện ly này (H 3PO 4, H 2CO 3…) thì sự điện ly trong
dung dịch gồm nhiều nấc và mỗi nấc có một giá trị K điện ly tương ứng.
Ví dụ:
+
H PO 4 H + H PO 4 - K 1
2
3
H PO 4 - H + HPO 4 2- K 2
+
2
+
HPO 4 2- H + PO 4 3- K 3
Hằng số điện ly K 1 thường có giá trị lớn gấp hàng trục ngàn lần so với K 2
và K 3 vì thế trong phép tính toán pH chỉ chú ý đến K 1.
Ví dụ: Tính pH của dung dịch H 2CO 3 0,1M
Trong dung dịch, có cân bằng điện ly sau đây:
49