Page 146 - Hóa dược
P. 146
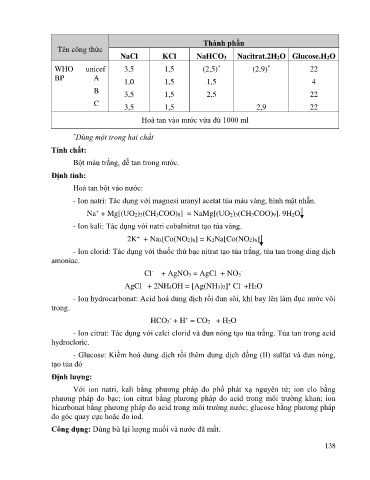
Thành phần
Tên công thức
NaCl KCl NaHCO3 Nacitrat.2H2O Glucose.H2O
WHO unicef 3,5 1,5 (2,5) (2,9) 22
*
*
BP A 1,0 1,5 1,5 4
B 3,5 1,5 2,5 22
C 3,5 1,5 2,9 22
Hoà tan vào nước vừa đủ 1000 ml
* Dùng một trong hai chất
Tính chất:
Bột màu trắng, dễ tan trong nước.
Định tính:
Hoà tan bột vào nước:
- Ion natri: Tác dụng với magnesi uranyl acetat tủa màu vàng, hình mặt nhẫn.
+
Na + Mg[(UO2)3(CH3COO)8] = NaMg[(UO2)3(CH3COO)9]. 9H2O
- Ion kali: Tác dụng với natri cobalnitrat tạo tủa vàng.
+
2K + Na3[Co(NO2)6] = K2Na[Co(NO2)6]
- Ion clorid: Tác dụng với thuốc thử bạc nitrat tạo tủa trắng, tủa tan trong ding dịch
amoniac.
-
Cl + AgNO3 = AgCl + NO3
-
AgCl + 2NH4OH = [Ag(NH3)2] Cl +H2O
-
+
- Ion hydrocarbonat: Acid hoá dung dịch rồi đun sôi, khí bay lên làm đục nước vôi
trong.
HCO3 + H = CO2 + H2O
+
-
- Ion citrat: Tác dụng với calci clorid và đun nóng tạo tủa trắng. Tủa tan trong acid
hydrocloric.
- Glucose: Kiềm hoá dung dịch rồi thêm dung dịch đồng (II) sulfat và đun nóng,
tạo tủa đỏ
Định lượng:
Với ion natri, kali bằng phương pháp đo phổ phát xạ nguyên tử; ion clo bằng
phương pháp đo bạc; ion citrat bằng phương pháp đo acid trong môi trường khan; ion
bicarbonat bằng phương pháp đo acid trong môi trường nước; glucose bằng phương pháp
đo góc quay cực hoặc đo iod.
Công dụng: Dùng bù lại lượng muối và nước đã mất.
138