Page 193 - Hóa phân tích
P. 193
(thể tích không đổi)
% NaOH % CH3COOH Tính chất Công thức tính pH Ghi chú
+
thêm vào còn lại dung dịch [H3O ]
0 100 Acid yếu 1 2,86
pH pK a lgC a
2
50 50 Cặp acid - 4,73
C
90 10 base liên pH pK a lg a 5,73
C m
99 1 hợp 6,73
99,9 0,1 7,73
100 Điểm tương
pH 1 ( pK lgC )
Base yếu 2 b b 8,87 đương
10
100,1 Base
-
101 mạnh pH = 14 + lg[OH ] 11
110 12
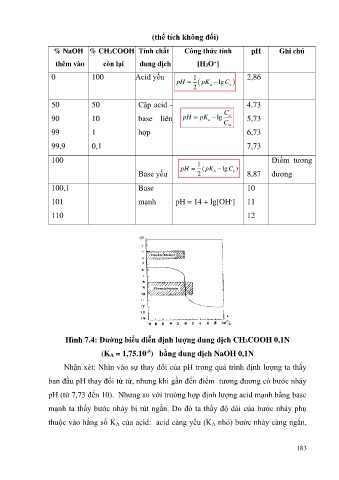
Hình 7.4: Đường biểu diễn định lượng dung dịch CH3COOH 0,1N
(KA = 1,75.10 ) bằng dung dịch NaOH 0,1N
-5
Nhận xét: Nhìn vào sự thay đổi của pH trong quá trình định lượng ta thấy
ban đầu pH thay đổi từ từ, nhưng khi gần đến điểm tương đương có bước nhảy
pH (từ 7,73 đến 10). Nhưng so với trường hợp định lượng acid mạnh bằng base
mạnh ta thấy bước nhảy bị rút ngắn. Do đó ta thấy độ dài của bước nhảy phụ
thuộc vào hằng số K A của acid: acid càng yếu (K A nhỏ) bước nhảy càng ngắn,
183