Page 28 - Thực hành Hóa phân tích
P. 28
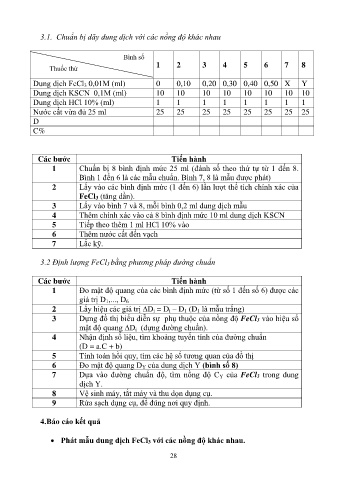
3.1. Chuẩn bị dãy dung dịch với các nồng độ khác nhau
Bình số
Thuốc thử 1 2 3 4 5 6 7 8
Dung dịch FeCl 3 0,01M (ml) 0 0,10 0,20 0,30 0,40 0,50 X Y
Dung dịch KSCN 0,1M (ml) 10 10 10 10 10 10 10 10
Dung dịch HCl 10% (ml) 1 1 1 1 1 1 1 1
Nước cất vừa đủ 25 ml 25 25 25 25 25 25 25 25
D
C%
Các bước Tiến hành
1 Chuẩn bị 8 bình định mức 25 ml (đánh số theo thứ tự từ 1 đến 8.
Bình 1 đến 6 là các mẫu chuẩn. Bình 7, 8 là mẫu được phát)
2 Lấy vào các bình định mức (1 đến 6) lần lượt thể tích chính xác của
FeCl3 (tăng dần).
3 Lấy vào bình 7 và 8, mỗi bình 0,2 ml dung dịch mẫu
4 Thêm chính xác vào cả 8 bình định mức 10 ml dung dịch KSCN
5 Tiếp theo thêm 1 ml HCl 10% vào
6 Thêm nước cất đến vạch
7 Lắc kỹ.
3.2 Định lượng FeCl 3 bằng phương pháp đường chuẩn
Các bước Tiến hành
1 Đo mật độ quang của các bình định mức (từ số 1 đến số 6) được các
giá trị D 1,..., D 6
2 Lấy hiệu các giá trị ∆D i = D i – D 1 (D 1 là mẫu trắng)
3 Dựng đồ thị biểu diễn sự phụ thuộc của nồng độ FeCl3 vào hiệu số
mật độ quang ∆D i (dựng đường chuẩn).
4 Nhận định số liệu, tìm khoảng tuyến tính của đường chuẩn
(D = a.C + b)
5 Tính toán hồi quy, tìm các hệ số tương quan của đồ thị
6 Đo mật độ quang D Y của dung dịch Y (bình số 8)
7 Dựa vào đường chuẩn độ, tìm nồng độ C Y của FeCl3 trong dung
dịch Y.
8 Vệ sinh máy, tắt máy và thu dọn dụng cụ.
9 Rửa sạch dụng cụ, để đúng nơi quy định.
4.Báo cáo kết quả
Phát mẫu dung dịch FeCl3 với các nồng độ khác nhau.
28